γ-H2AXに対する蛍光標識抗体によって、放射線被ばく後に細胞核内に生じるγ-H2AXを顕微鏡下で観察することができる。γ-H2AXは被ばく直後に最も多く経時的に減少していくパルス電気泳動法によって生化学的に定量したDSBの数と免疫蛍光法によって顕微鏡下で検出定量したγ-H2AXの数が近いことは、γ-H2AXが個々のDSBを検出していることの証拠となる。さらに高DNA修復機能を持つ細胞でも、DNA修復機能欠損細胞でもγ-H2AXの消去の様子はDSB修復の様子と非常に似通っている。このようにγ-H2AXの免疫蛍光法による検出が被ばくによって生じるDSBの修復を視覚的に表わしているのみならず、細胞内の個々のDNA修復の定量を可能にしている。MRC-5細胞を用いて1.2mGyから2Gyの被ばくによって生じるγ-H2AXの分析から、この線量範囲では被ばく線量と生じるγ-H2AXの数に直線的な相関があることが明らかになった。この結果はこのような広い線量範囲にわたって被ばく線量とDSBの生成が相関しているということに対する直接的な証拠となる。1-10mGyという線量は普通のX線検査や診断で用いられる線量である。また一般人が環境からの自然放射線として受ける年間線量の範囲でもある。1mGyというのは、培養されているヒト繊維芽細胞の核がちょうど1個の放射線粒子によって通過される線量であり、ひとつの細胞が放射線によって被ばくを受ける場合の最低線量でもある。つまりこれより小さな線量の場合には放射線粒子が通り抜ける細胞数(被ばくする細胞数)が減少してゆくだけで、被ばくする細胞の被ばく線量が減少するわけではない。したがって細胞が受けることのできる最低線量となる。
被ばくの瞬間に生じるDSBの数は被ばく線量に比例するが、ある時間の経過後に残っているDSBの数は被ばく線量には関係ない。つまり1.2、5、20、200mGyの被ばくによってできるDSBが修復され、24時間後に残っている数は、いずれも細胞あたりDSB約0.1個(10細胞あたりDSB1個)という結果となった。この結果は、異なる継代数の細胞で、被ばく前のコンフルエント(細胞培養皿に細胞が満杯になったために、それ以上細胞分裂できなくなった状態)の期間をいろいろに取った場合でも同じように得られた。この値は自然放射線被ばくによって細胞に自然に発生しているDSB数0.05とは有意に違っている。細胞あたり0.1個のDSBというのは、1.2mGyを被ばくした場合にできるDSBの数に相当する。さらにこのような修復されないDSBは14日後にも変わらず残っている。
被ばく後にある数(0.1個/細胞)のDSBが、被ばく線量とは関係なく残っているという結果は、被ばく後アポトーシスやバイスタンダー効果と呼ばれる作用によってDNA の傷害が起こり、そのために新たにできたDSBが原因となっていると考えることもできる。そのために被ばく線量とは関係なくある一定の量になるのかもしれない。もしそうなら、ここで見ている0.1個/細胞というDSBは残っているDSBではなく、被ばく後にあらたに生じるDSBをみていることになる。そして低線量の被ばく後にははじめにあったDSBに上乗せされる形で増えていくことになるだろう。しかし実際には、細胞あたりの平均DSB数も、あるDSB数をもつ細胞の分布も1.2mGy被ばく後時間が経っても変化しない。つまり被ばく後にDSBがあらたに生じることはないことを示している。さらに0.1あるいは0.5mGy被ばく後24時間の時点でのDSB数はこれらの線量の被ばく直後に生じるDSB数を超えることはない。これらの事実から、時間が経っても残っているDSB数は、"修復されなかった"DSBの数を表していると結論できる。1.2mGyを被ばくした細胞の場合にはDSBはすべて修復されていないことになり、この結果がたまたまDNA修復機能を欠損した一部の細胞によるものだとは考えられない。
細胞がコンフルエントに保たれればこの0.1個/細胞のDSBは数日間残り、繰り返し被ばくによって生じる増加分のDSBは、すべて効率よく修復され消去されることも明らかになった。このように我々のデータはあるしきい値となる線量が存在し、その線量より大きい線量によるDNA傷害は効率よく修復され、またそれ以下の線量による傷害は修復できないということを示唆しているように思われる。興味深いことに、このしきい線量と考えられる1mGyというのは、培養ヒト繊維芽細胞ではちょうど細胞ひとつあたり1個の電子線が通過する線量である。
現在低線量被ばくのリスク評価は高線量被ばくのデータからの外挿で行われている。このモデルは高線量でも低線量でも細胞は同じような修復能力をもつという仮定のもとに成り立っている。ここで示したデータは明らかにこの仮定には反している。そして直線仮説モデルはリスクを過小評価していることも示唆している。しかし、一方で細胞がコンフルエントな場合(細胞分裂ができない状態)にのみ、修復されないDSBが残るということはよく考える必要がある。被ばく後に細胞を分裂できる状態におくと、2-3回の細胞分裂ののちにはDSB数は被ばくしない時のレベルにまで低下した。同時に小核形成細胞とアポトーシス細胞が増加した。これらのことは、被ばく後自由に分裂できる場合には、未修復DSBを持つ細胞は細胞死によって消去されることを表している。このことは1.2mSv被ばく後には細胞生存率が顕著に低下することによっても裏付けられる。これらの結果から、非常に低いある線量以下の被ばくの場合にはDSB修復機能が働かないが、そのために発がんリスクが増加することはなく、むしろリスクを低下させるためのメカニズムとなっている可能性も考えられる。つまり傷害が少ない場合にはDSBを修復することで突然変異を固定化する危険をおかすより、むしろそれらの細胞を細胞死させて除去することを選ぶ方が生体にとって安全であると判断しているのかもしれない。しかしこの推測は証明される必要がある。
非常に低い線量を被ばくした細胞はDSB修復できないということを利用して、被ばく細胞と被ばくしていない細胞を見分けることができるだろう。ここで述べたγ-H2AXの検出法は低い線量を被ばくしたヒトのバイオドシメトリーとして利用可能である。がん放射線治療においても利用できるし、職業被ばくあるいは検査被ばくの線量見積もりにも利用できるだろう。
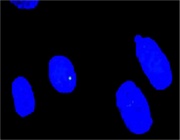
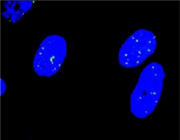
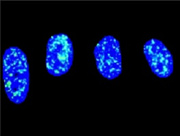
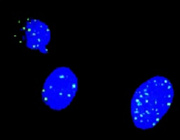
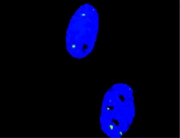
図1 DSBの検出
180BRヒト繊維芽細胞の初代培養細胞。γ-H2AX集合体は緑色に染色、青い領域は細胞核。
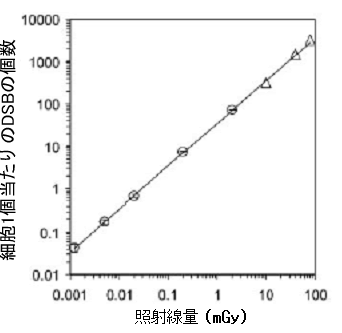
図2 MRC-5ヒト繊維芽細胞でのDSBの発生
γ-H2AX集合体は照射後3分の時点で計数した。○印はγ-H2AX集合体数の平均値。△印はパルスフィールド電気泳動によって求めたDSB数。
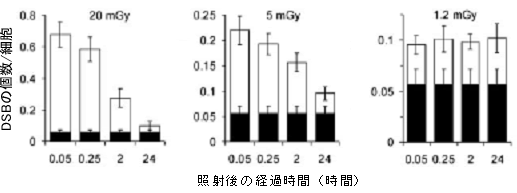
図3 照射後の経過時間とDSB修復
MRC-5細胞。それぞれの線量で照射してその後の経時的な修復を測定した。黒いバーが照射をしない対照群のDSB数、白いバーが照射によって生じたDSB数を表す。20mGy、5mGyともに照射直後に白いバーが最も高くなりその後時間とともに減少し、最終的には0.1に落ち着く。一方1.2mGyの場合には照射後に0.1に増加するもののその後減少することはなく、24時間後もそのレベルと保ったままである。
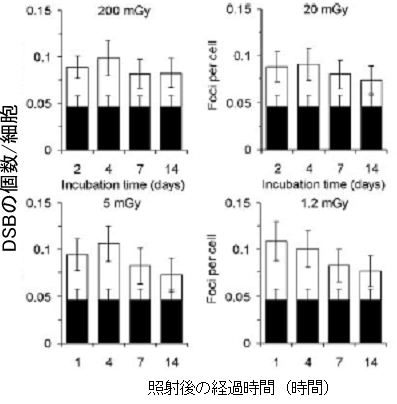
図4 照射後の時間経過とDSB修復(長時間)
図3と同じ条件。照射後14日経過してもほぼ0.1のレベルを保ったままである。
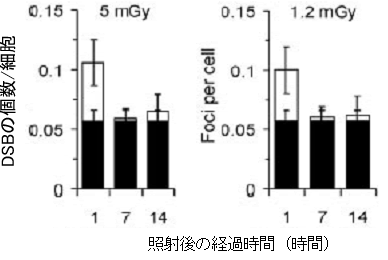
図5 照射後の時間経過とDSB修復(細胞分裂可能)
照射後、細胞分裂ができる状態においた場合には5mSv、1.2mSvともに照射によって増加した部分(白いバーの部分)のDSBは完全に消去される。