マイクロビーム照射
厳密な数のアルファ粒子を細胞に照射できる。アルファ粒子エネルギーは5.3MeV(LET: 90keV/マイクロm、Rn-222から放出されるアルファ粒子と同じエネルギーレベル)260,000個の細胞に照射し、最終的に110,000個の細胞の発がん可能性を評価した。ブロードビーム照射
ポアソン分布にしたがった数のアルファ粒子を細胞に照射できる。5.3MeVアルファ粒子を最終的なフルエンスが得られるようにディッシュ全体に照射してゆく。500,000個の細胞を分析した。発がん性の評価
照射後7週間培養し、発生するタイプIIとタイプIIIの変異細胞集団の数(変異細胞発生頻度、変異頻度)を計測する。
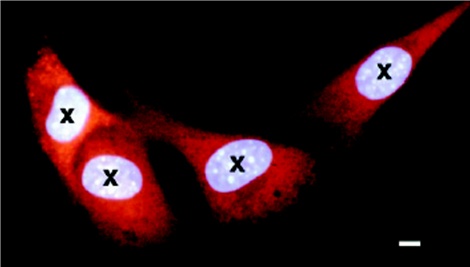
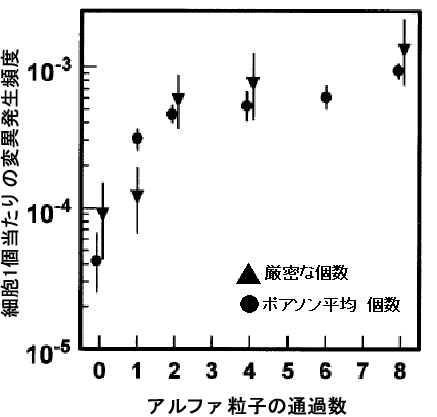
図1はマイクロビーム照射のターゲットとなる細胞の蛍光顕微鏡像。図2は異なる数のアルファ粒子を照射した場合のマイクロビーム照射とブロードビーム照射の結果の比較。照射しない場合(個数=0)の変異頻度は有意差なく、同じと考えられる(p=0.28)。照射個数が複数(2、4、8個)の場合にはマイクロビーム照射とブロードビーム照射で得られる変異頻度は等しく、先に述べたように照射線量や細胞の取り扱いがこの二種類の照射でほぼ同等であることが確認できる。このことを前提に、アルファ粒子個数が1個の場合の結果を見ると有意な差が認められる。図3ではアルファ粒子個数1個の場合の結果を詳細に示した。
図1 マイクロビームターゲット ポリプロピレン製培養ディッシュ表面に培養されているC3H10T1/2細胞が、自動マイクロビーム画像システムによってモニターされている。赤く見えるのが細胞の全体、その中の細胞核はヘキスト33,342で薄い青色に染色されている。これらの細胞核の位置を事前に×印でマークしておくと、決められた数のアルファ粒子が自動的にこれら×印の位置に順次照射される。(バーの長さ:7マイクロm)
図2 5.3MeVアルファ粒子の通過による変異細胞の発生頻度
▼印:厳密な数のアルファ粒子の照射
●印:ポアソン平均数のアルファ粒子の照射
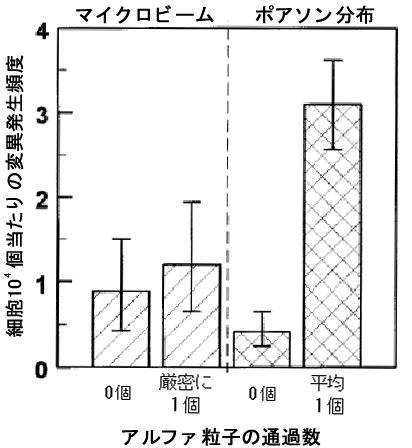
図3 厳密に1個、あるいはポアソン平均1個のアルファ粒子の通過による変異細胞の発生頻度
マイクロビーム照射による"厳密に1個"の場合の粒子の通過個数はもちろん100%の細胞で1個だが、ブロードビーム照射による"ポアソン平均1個"の場合には74%の細胞で1個だが26%の細胞では2個以上の粒子が通過している。変異頻度はそれぞれ1.2と3.1であり、差は統計的に有意だった(p=0.02)。つまり"厳密に1個"通過した場合はコントロール(個数=0)とは差がないが、複数個の粒子の通過が混在している場合よりは有意に少ないことが明らかになった。この差は2個以上の粒子が通過した26%の細胞によって生じていると考えられる。低線量被ばくの疫学的には十分な正確さを持っては評価できないために、ウラン坑夫の高線量被ばく疫学データからの外挿でおこなっているのが現状だ。ここで示したように、もし厳密に1個のアルファ粒子の通過では細胞変異が増加しないなら、変異細胞が生じるには複数個のアルファ粒子の通過が必要だということになり、家庭における日常のラドンリスクの評価に重大な意味をもつことになるだろう。というのは家庭でのラドン被ばくは、気管支上皮細胞では生涯にわたって1個を超えることはないからだ。つまりこれまでおこなってきた家庭のラドンリスクの見積もりは、深刻な過大評価である可能性がある。
ここではマウス繊維芽細胞C3H10T1/2細胞を用いた結果を報告したが、これはヒト細胞では同様な結果が得られないためではなく、放射線による細胞変異を計測する適切な実験系がヒト細胞では確立されていないためである。したがってここで得られた結果はまだヒト細胞では確認されていないということにも留意しておく必要がある。