
抗酸化酵素の活性化
生体内で種々の活性酸素種を発生することにより細胞障害を惹起する紫外線、抗がん剤、種々の金属などに曝露させると、適応応答として、生体はGSHのみならず、種々の抗酸化酵素を誘導することは先に述べた通りである。放射線の細胞障害性の本体も、主として、生体内の水分子の励起によって生ずる活性酸素種であることから、これらと同様な適応応答が容易に予想される。
低線量放射線による抗酸化酵素の誘導に関する研究は、きわめて少ない。そこで筆者らの研究を中心に、放射線、特に低線量放射線の抗酸化酵素に対する作用をSOD、GPXおよびカタラーゼの各酵素について紹介する。
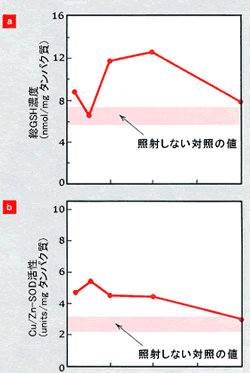 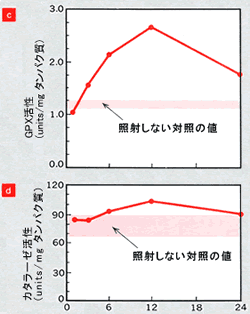
|
1)SOD活性
SODには、主として細胞質に存在するCu/Zn-SOD、ミトコンドリアに存在するMn-SODが知られている。γ線照射(50 cGy)によりGSH誘導のみられたC57Bl/6マウスを用い、SOD活性の変化を検討したところ、肝臓ではおもにCu/Zn-SODが図4bに示すようにγ線照射3時間後に有意に活性が上昇し、この上昇はその後12時間持続して24時間後には正常な活性に戻った。また脳についてもほぼ同様の活性変化がみられた(文献6)。この結果は、25
cGy のX線を成熟ラットに全身照射し、脾臓中に含まれるSODについて調べたところ、主としてCu/Zn-SOD mRNAがX線の照射後ただちに増加したという他の実験例と一致した(文献7)。
2)GPX活性
SODはO2−をH2O2に不均化する酵素であるため、生じたH2O2がさらにH2OとO2に無毒化されるか否かを検討する必要がある。この反応を触媒する酵素であるGPXに放射線はどのように作用するのだろうか。図4c
は、やはり同一マウスに50 cGy のγ線を1回全身照射した後の肝臓GPX活性の変化を示したものである。GPX活性はγ線照射後、ただちに上昇し、12時間後に最大活性に達し、その後徐々に低下するものの、24時間後まで高い活性が維持された(文献8)。この活性変化は先に述べた肝GSH量の変化(図4a)とよく一致し、GPXがGSH合成経路での再生サイクル系の酵素の一つであることからも、当然の結果といえよう。これらの結果より、GPXは放射線照射によるGSH誘導のために活性化されるのみならず、放射線照射後のSOD活性の亢進とともに生じたH2O2をH2OとO2に無毒化させるためにGPX活性が亢進するものと考えられる。この仮説は、低線量X線照射後のラット脾臓でSOD活性とともにGPX活性が上昇するという結果からも支持される(文献9)。
3)カタラーゼ活性
肝臓では、γ線照射12時間後にわずかなカタラーゼ活性の上昇がみられた(図4d、文献6)。一方、脳ではγ線照射後ただちに、活性の上昇がみられ、12時間後まで有意に高い活性が維持され、24時間後に非照射群とほぼ同程度の活性に戻るという変化がみられた。カタラーゼは肝臓、腎臓などのペルオキシソーム(細胞内小器官の一つ)に存在する。組織内で発生した過酸化水素の消去を行い、炎症性サイトカインである腫瘍壊死因子(TNF‐α)、インターロイキン6(IL‐6)により誘導されることから、放射線照射によるこれらのサイトカインの誘導を介してカタラーゼ活性の上昇がみられたと考えられる。
ホームページに関するご意見・ご感想をこちらまでお寄せ下さい。![]()
メールアドレス:rah@iips.co.jp