丂

丂
奺庬幘姵偵懳偡傞梊杊丒帯椕傊偺
掅慄検曻幩慄偺墳梡偺壜擻惈
丂偙傟傑偱弎傋偰偒偨傛偆偵丄掅慄検曻幩慄偵懳偡傞惗懱揔墳墳摎偺堦偮偲偟偰丄慻怐偺峈巁壔婡擻偑妶惈壔偝傟傞偲偄偆幚尡揑寢壥傪徯夘偟偰偒偨丅偙傟偵婎偯偒丄埲壓丄偙偺嶌梡傪妶惈巁慺庬偑偦偺敪徢偁傞偄偼恑揥偵娭梌偡傞偲峫偊傜傟偰偄傞庬乆偺幘姵偺梊杊傗帯椕偵梡偄傞偙偲偺壜擻惈偵偮偄偰丄昅幰傜偺僌儖乕僾偑峴偭偨摦暔幚尡儌僨儖偐傜扵偭偰傒傞丅
侾乯娞憻忈奞乮帀朾娞乯偵懳偡傞嶌梡
丂掅慄検曻幩慄偵傛傝儅僂僗娞憻偱丄GSH偺傒側傜偢峈巁壔峺慺偑桿摫偝傟傞偙偲偑丄偡偱偵柧傜偐偲側偭偰偄傞丅偦偙偱丄巐墫壔扽慺乮CCl4乯傪梡偄丄娞憻忈奞乮帀朾娞乯儌僨儖傪嶌惢偟丄娞憻忈奞偵懳偡傞掅慄検曻幩慄偺嶌梡傪専摙偟偨丅偙偺CCl4偼娞嵶朎儈僋儘僜乕儉偱戙幱偝傟丄儔僕僇儖乮CCl3j偲側傝丄嵶朎枌帀幙偺夁巁壔傪夘偟偰嵶朎忈奞惈傪庝婲偡傞丅
丂偁傜偐偠傔丄CCl4傪搳梌偟偨儅僂僗偵50 cGy 偺兞慄傪侾夞丄儅僂僗偺慡恎徠幩偟偨丅偼偠傔CCl4偵傛偭偰帀朾娞忬懺偵側偭偰墿怓偔傒偊偨娞憻偼丄兞慄徠幩屻俁擔栚偱娞憻偵愒傒偑栠偭偰偒偰偄傞偺偑娤嶡偱偒偨丅偙傟偵懳偟丄徠幩傪峴傢側偐偭偨儅僂僗偺娞憻偼丄埶慠偲偟偰墿怓枴偑偑傝夞暅偺抶傟偑傒傜傟偨丅
丂恾俆偼丄偙偺儅僂僗偺娞憻忈奞偺廳撃偝傪昞偡寣惔拞僩儔儞僗傾儈僫乕僛乮GOT丄GPT乯妶惈偺曄壔傪帵偡丅偙傟傛傝CCl4偵傛傝尠挊偵崅傔傜傟偨GOT偍傛傃GPT妶惈偼丄曻幩慄徠幩偵傛傝丄偄偢傟傕桳堄偵梷惂偝傟偨丅懠偺慻怐忈奞偺儅乕僇乕偱偁傞夁巁壔帀幙傪CCl4搳梌孮偲斾妑偟偨応崌偵傕曻幩慄徠幩孮偱桳堄偵梷惂偝傟傞偙偲偑傢偐偭偰偄傞丅
丂
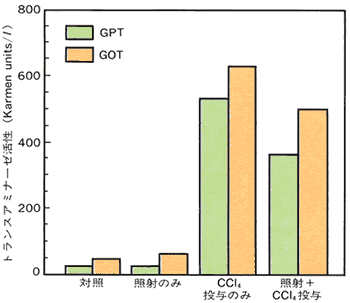
| 恾5 | CCl4偵傛傝娞憻忈奞傪惗偠偨儅僂僗傊掅慄検兞慄傪徠幩偟偨屻偺寣惔拞僩儔儞僗傾儈僫乕僛妶惈偺曄壔 |
丂
俀乯鋁憻忈奞乮摐擜昦敪徢乯偵懳偡傞嶌梡
丂儅僂僗偵傾儘僉僒儞偲偄偆栻嵻傪搳梌偡傞偲丄鋁搰乮鋁憻偺儔儞僎儖僴儞僗搰乯兝嵶朎偑慖戰揑偵攋夡偝傟偰僀儞僗儕儞偺暘斿偑梷惂偝傟丄僀儞僗儕儞埶懚宆摐擜昦忬懺偑桿敪偝傟傞丅偙傟偼丄鋁搰兝嵶朎偺傾儘僉僒儞偵懳偡傞斀墳惈偑娞嵶朎傗愒寣媴偵斾傋偰崅偄偵傕偐偐傢傜偢丄SOD丄僇僞儔乕僛丄GPX側偳偺妶惈偑掅偔丄傾儘僉僒儞偐傜嶻惗偝傟傞妶惈巁慺偺忈奞傪庴偗傗偡偄偨傔偱偼側偄偐偲峫偊傜傟偰偄傞丅偙偺壖愢偼丄SOD傗峈巁壔嵻傪帠慜偵搳梌偡傞偲丄傾儘僉僒儞偵傛偭偰桿敪偝傟傞摐擜昦敪徢偑寉尭偝傟傞偙偲偐傜傕巟帩偝傟傞丅
丂偙傟傑偱偺寢壥偲摨條偵丄掅慄検曻幩慄偺徠幩偵傛偭偰丄鋁搰兝嵶朎偺SOD妶惈偑槾恑偡傟偽丄傾儘僉僒儞搳梌偵傛傝桿摫偝傟傞摐擜昦徢忬偑梷惂偝傟傞壜擻惈偑偁傞丅偦偙偱丄傾儘僉僒儞搳梌偺俀乣俁廡娫慜偵儔僢僩偵25乣200 cGy 偺兞慄乮60Co乯傪徠幩偟丄寣摐抣偺曄壔偐傜曻幩慄偺傾儘僉僒儞桿摫摐擜昦敪徢偵懳偡傞嶌梡傪専摙偟偨椺偑偁傞乮暥專10乯丅傾儘僉僒儞傪搳梌偟側偄応崌丄鋁憻偺SOD妶惈偼丄50 cGy 偍傛傃100 cGy 偱偼丄兞慄徠幩偵傛傝憹壛偡傞孹岦傪帵偟偨丅偟偐偟丄傾儘僉僒儞傪搳梌偡傞偲丄50 cGy 徠幩孮傪彍偔偡傋偰偺孮偱SOD妶惈偑梷惂偝傟偨丅堦曽丄鋁憻拞偺夁巁壔帀幙検偼傾儘僉僒儞傪搳梌偡傞偲丄徠幩偟側偄孮丄25 cGy 偍傛傃200 cGy 偺奺徠幩孮偱偼丄傾儘僉僒儞旕搳梌偺応崌偵斾傋偰夁巁壔帀幙検偑憹壛偟偨丅偙傟偵懳偟偰丄50 cGy 偍傛傃100 cGy 徠幩孮偱偼丄傾儘僉僒儞旕搳梌偺応崌偲摨偠掱搙偱偁偭偨丅傾儘僉僒儞旕搳梌偺儔僢僩偺寣摐抣偼丄偡傋偰偺孮偵偍偄偰200 cGy 埲壓偺慄検偱偼兞慄徠幩偺塭嬁傪庴偗側偐偭偨丅偙傟偵懳偟偰丄傾儘僉僒儞搳梌孮偱偼丄50 cGy 徠幩孮傪彍偒丄偄偢傟傕栺500 mg 乮侾dl拞偺寣摐抣乯傪帵偟偨乮恾俇乯丅僀儞僗儕儞埶懚宆摐擜昦偱偼丄鋁慻怐廳検偺掅壓丄兝嵶朎偺暘斿梓棻偺扙棊側偳傪惗偠傞丅幨恀侾偵帵偡傛偆偵丄旕徠幩偱傾儘僉僒儞旕搳梌偺儔僢僩偺鋁搰偵偼丄傾儖僨僸僪僼僋僔儞偱擹偔愼怓偝傟傞暘斿梓棻偱枮偨偝傟偨兝嵶朎偑擣傔傜傟傞丅傾儘僉僒儞傪搳梌偡傞偲懡偔偺兝嵶朎偑夡巰偟嵶朎妀偑嬅弅偟偰丄巆懚偡傞兝嵶朎偱傕暘斿梓棻偑尭彮偟偰偄偨丅偙傟偵懳偟偰丄50 cGy 徠幩孮偱偼丄兝嵶朎偺夡巰偵敽偆妀偺擹弅偼娤嶡偝傟偨偑丄嵶朎悢丒暘斿梓棻偺尭彮偼丄拞掱搙偵偲偳傑偭偰偄偨丅埲忋偺娤嶡寢壥偼丄傾儘僉僒儞偺嶻惗偡傞妶惈巁慺偑傕偨傜偡兝嵶朎偺忈奞偑50 cGy 偺兞慄帠慜徠幩偵傛傝偁傞掱搙娚榓偝傟偨偙偲傪棤晅偗傞傕偺偱偁傠偆丅
丂
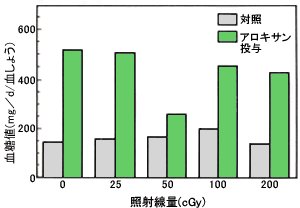
| 恾6 | 傾儘僉僒儞偵傛傝摐擜昦忬懺偵偟偨儔僢僩傊掅慄検兞慄傪徠幩偟偨屻偺寣摐抣偺曄壔 |
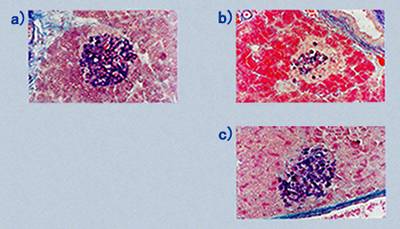
| 幨恀1 | 傾儘僉僒儞偵傛傝桿摫偟偨摐擜昦偵傒傞鋁搰兝嵶朎忈奞偲掅慄検兞慄偵傛傞偦偺梷惂 | ||
|
|
a)惓忢儔僢僩鋁憻偺兝嵶朎 | ||
|
|
b)摐擜昦偵傒傜傟傞暘斿梓棻偺尭彮(嵶朎忈奞) | ||
|
|
c)50cGy偺兞慄帠慜徠幩偵傛傞暘斿梓棻尭彮偺梷惂 |
丂
丂偝傜偵丄僸僩偺嘥宆摐擜昦乮僀儞僗儕儞埶懚宆摐擜昦乯偺儌僨儖儅僂僗偱偁傞NOD乮旕旍枮惈摐擜昦乯儅僂僗傪梡偄偨幚尡偵偍偄偰傕丄惗屻13廡栚偵50 cGy 偺兞慄傪侾夞慡恎徠幩偡傞偙偲偵傛傝丄捠忢丄杮儌僨儖儅僂僗偱15廡栚埲崀偵敪惗偡傞擜拞傊偺僌儖僐乕僗攔煏傪尠挊偵掅壓偝偣傞偲偄偆寢壥傕昅幰傜偺僌儖乕僾偵傛傝摼傜傟偰偄傞丅
丂埲忋丄偄偢傟偺儌僨儖幚尡偵偍偄偰傕丄掅慄検偺曻幩慄乮兞慄乯偺徠幩偵傛傝丄偍偺偍偺偺忈奞偑桳堄偵梷惂偝傟偨丅偙傟傜偺梷惂岠壥偼丄曻幩慄偵懳偡傞惗懱偺揔墳墳摎偺寢壥惗偠偨GSH偍傛傃峈巁壔峺慺偐傜側傞杊屼婡峔偺桿敪尰徾傪棙梡偟偨傕偺偑堦場偲峫嶡偝傟傞丅敪偑傫傪偼偠傔偲偡傞庬乆偺曻幩慄偵傛傞恎懱揑忈奞傗堚揱揑忈奞偺敪惗偵婎偯偔慄検婯惂傪崕暈偱偒傟偽丄掅慄検曻幩慄傪庬乆偺妶惈巁慺娭楢幘姵偺梊杊傗帯椕偵梡偄傞偙偲傕壜擻偲峫偊傜傟傞偺偱偁傞丅側偍丄嵶朎宯偵拝栚偟偨尋媶幰偼丄傾億僩乕僔僗側偳偺嵶朎撪忣曬揱払傪娤揰偵掅慄検曻幩慄徠幩偺桳梡惈偵偮偄偰専摙偟丄懡偔偺曬崘傪偟偰偄傞丅